職位推薦
- 珍格醫療-臨床銷售 15001-20000
- 地奧制藥-醫藥代表 6001-8000
- 普利德醫療-醫療設備銷售經理 面議
- 大唐-兼職招商經理 面議
- 景德中藥-直營經理 6001-8000
- 安邦醫藥-省區招商經理 8001-10000
- 恒瑞醫藥-醫藥信息溝通專員 6001-8000
- 黃河中藥-學術講師 8001-10000
發布日期:2025-02-21 瀏覽次數:51

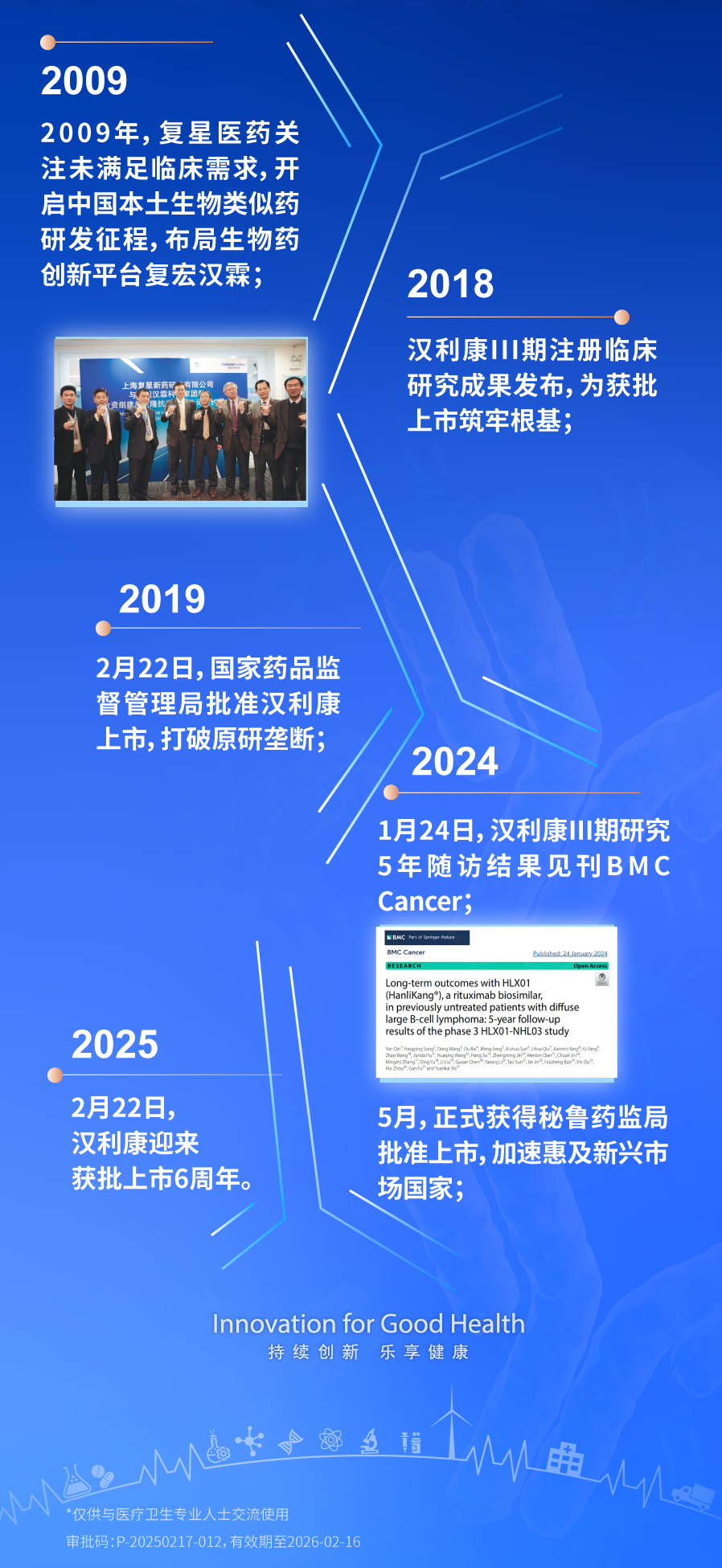
10年研發,6年愈證,2025年2月22日,中國首個自主研發的CD20單抗生物類似藥漢利康®迎來上市6周年。自獲批至今,漢利康®以卓越的臨床價值與可及性,不僅填補了國內生物類似藥領域空白,更推動淋巴瘤診療邁向規范化、普惠化,并于2024年首次迎來海外獲批,加速惠及全球患者。






01
打破壟斷,開啟中國生物類似藥新紀元
利妥昔單抗作為首個用于淋巴瘤治療的單克隆抗體,開創了免疫化療的新紀元。在彌漫大B細胞淋巴瘤(DLBCL)和濾泡淋巴瘤(FL)一線治療中,利妥昔單抗是核心藥物,顯著提高了療效和生存率。然而,其高昂價格限制了其廣泛應用。復星醫藥自主研發的中國首個自研CD20單抗漢利康®的誕生,標志著中國生物類似藥研發實現“零的突破”。其研發歷時十年,通過嚴格的III期臨床研究及5年隨訪數據驗證,證實其與原研藥在療效、安全性上高度一致,且價格僅為原研藥的1/3。這一突破不僅打破了外資藥企的長期壟斷,更推動原研藥價格大幅下調并加速納入醫保,極大提升了藥物可及性。?
漢利康®的上市,為中國生物類似藥研發樹立了高質量標桿。其遵循國際標準的研發路徑,促進了行業技術標準化與監管體系完善,帶動國內生物藥領域進入快速發展期。截至目前,以漢利康®為代表的利妥昔單抗已推動大中城市三甲醫院淋巴瘤患者5年無病生存率從20%提升至50%,成為我國生物醫藥自主創新的典范。
02
循證為基:臨床研究力證長期療效與安全性
漢利康®的核心競爭力源于扎實的循證醫學支持。III期HLX01-NHL03研究納入407例初治彌漫大B細胞淋巴瘤(DLBCL)患者,經過65個月長期隨訪顯示:漢利康®聯合化療(H-CHOP)組與原研藥聯合化療(R-CHOP)組的5年總生存率(OS)分別為81%和75.4%,無進展生存率(PFS)分別為77.7%和73%,兩組無統計學差異,且安全性表現一致。這一成果被國際權威期刊《BMC Cancer》收錄,為漢利康®的等效性提供了強有力證據。
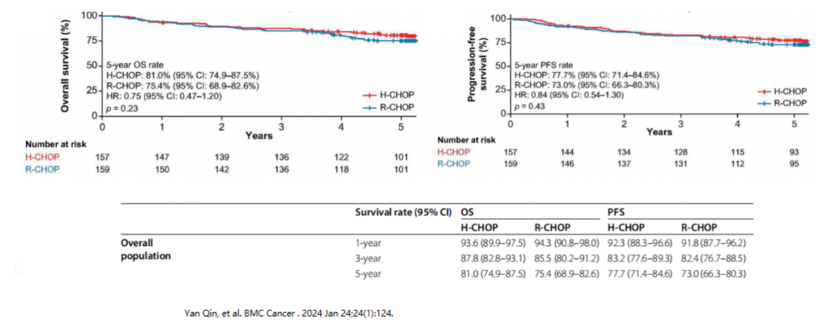
總體人群5年OS:H-CHOP組 81.0%,R-CHOP組 75.4%,無統計學差異
在惰性淋巴瘤領域,漢利康®聯合長效干擾素的RIPPLE研究同樣成果顯著。中位隨訪34.2個月的數據顯示,初治晚期濾泡淋巴瘤(FL)患者的完全緩解率達50.9%,3年PFS和OS分別為70.4%和92.5%,為早期干預提供了新思路。此外,漢利康®在真實世界中的應用進一步驗證其療效:覆蓋全國超千家醫療機構的臨床實踐表明,其毒副反應可控、使用便捷,已成為醫生和患者的優選方案。?
03
普惠患者:可及性驅動診療格局變革
漢利康®的上市,直接推動了淋巴瘤治療的“普惠化”。原研藥價格曾導致85%的患者因經濟負擔中斷治療,而漢利康®通過醫保談判大幅降低用藥成本,使更多患者能夠完成規范治療周期。據統計,以漢利康®為代表的利妥昔單抗上市后,我國DLBCL患者接受免疫化療的比例提升40%,基層醫院淋巴瘤診療能力同步增強。?
其臨床價值還體現在治療策略優化上。對于老年體弱或低腫瘤負荷的FL患者,漢利康®單藥治療被證實安全有效,成為國內外指南推薦的一線方案;在聯合治療領域,其與化療、靶向藥物的協同作用,為個體化治療提供了更多可能。行業專家指出,漢利康®的示范效應將加速更多優質生物類似藥上市,形成良性競爭生態。與此同時,其長期隨訪數據的積累,為全球生物類似藥研發提供了“中國經驗”。2024年5月,漢利康®正式獲得秘魯藥監局批準上市,商品名為AUDEXA®。作為中國首個生物類似藥的漢利康®首次迎來海外獲批,將加速惠及新興市場國家。
6年來,漢利康®以“自研+普惠”雙輪驅動,改寫了中國淋巴瘤治療史。未來,隨著更多臨床研究的推進與適應癥拓展,漢利康®有望進一步鞏固其在血液腫瘤領域的核心地位,并助力中國在全球生物醫藥賽道占據更重要的位置。?
正如行業所期許:“漢利康®的歷程證明,自主創新與患者需求深度融合,方能催生改變時代的良藥。”在下一個6年,復星醫藥人將繼續以創新驅動為核心,讓更多“可及可愈”的創新成果惠及全球。

300多萬優質簡歷
17年行業積淀
2萬多家合作名企業

微信掃一掃 使用小程序

